EL Carbono
El carbono
El carbono es un elemento Químico muy abundante en la naturaleza se puede hallar ligado a demasiados elementos Químicos.
El
símbolo del carbono es la C, su numero atómico es 6 y su peso molecular
es 12,07 g/mol , su configuración electrónica es 1s2s2p para un total
de 6 electrones , esde carácter no metálico y no magnético y su estado
es solido.

Imagen tomada de:
https://clickmica.fundaciondescubre.es/files/2016/12/carbono-768x474.png
Las propiedades químicas del carbono le permiten enlazarse con muchos
otros átomos de la tabla periódica, para formar variados tipos de enormes y complejasde moléculas que crea el carbono gracias a su
enlace covalente con el mismo C-C o C-H con el hidrógeno., son tantos los elementos que puede crear el carbono que hay
toda una rama de estudio para el denominadaquimica organica o química del carbono.
imagen tomada de:http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena12/imagenes12/carbono.jpg
El carbono presenta características alotrópicas( es la propiedad de algunas sustancias simples de poseer estructuras atómicas o moleculares diferentes), gracias a ello en formas muy básicas del Carbón podemos encontrar sus derivados como el grafito y diamante.
Podemos ver el Grafito utilizado en el lápiz y el diamante de su paso del carbón al diamante.
Imagenes tomadas de:
https://nanosostenible.files.wordpress.com/2018/02/tantolosdiamantes.png?w=405&h=301
En base a la geometría molecular el carbono tiene una forma tetraedica ya que los átomos de hidrógeno forman un enlace covalente con el carbono y se posicionan en cada uno de los vértices del tetraedro y el espacio que hay entres los átomos de hidrógeno es de 109'5 grados esto es por las repulsiones electrónicas entre átomo y átomo . como lo observamos en la siguiente imagen.
Imagen tomada de: https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgZmOxYAde8op055QQH1SyEoiMNQ4-xo0U_qNbGwezePzUpilUgE3qJV45xs8dcr3e5F05Y0xTsJT5ghv0kJksB-NjW-XyF_3_Zo7whu67m-H1rU9v8K4Cx7TlMvn9CvaU1QWvuXnRixQo/s1600/CH4.gif
El carbono para enlazarse con otros atomos o moléculas puede "hibridar" con la formacion de orbitales moleculares de enlace que le permiten unirse a el mismo u a otros atomos para formar nuevos compuestos.
Hay tres tipos de hibridacion la sencilla Sp3, doble Sp2 y triple Sp
Hay tres tipos de hibridacion la sencilla Sp3, doble Sp2 y triple Sp
Para el caso del Metano(hidrocarburo sencillo que se presenta en forma de gas) CH4 se muestra el tetraedro sin enlazar con otro componente para ejemplo del Sp3
Fuente:http://www.robertopascua.com/wp-content/uploads/2016/07/Figura_6.png
Para la hibridacion Sp2 es una union carbono carbono con un doble enlace covalente, separando a sus átomos de hidrógeno en un angulo de 120 grados del carbono.
Fuente:https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiLI7krOv1fZ2sfhlstU4eqzjBRGiK29TjLbsd6DEkXtTgBE75mjZQzP4YHc-KD1ORHYpG3uKAk0uAcsO6-JgwIrqpXMTazGeuNvreYVyhkQoYjemTEacHJd_XbSsCEd2wwEQiC4yqHVNkl/s1600/198px-AE3h.svg.png
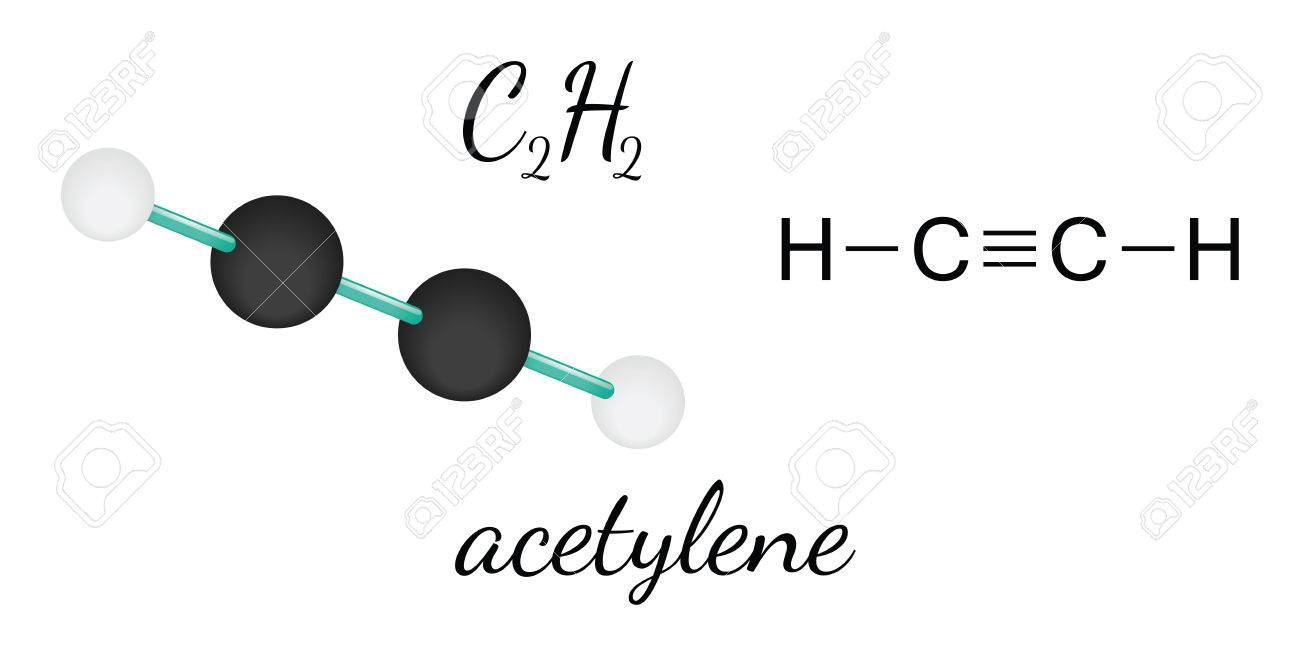
para la hibridación de Sp los átomos que se hibridan ponen en juego dos orbitales , formando de esa manera un ángulo de 180 grados
Fuente: https://www.caracteristicass.de/wp-content/uploads/2018/05/caracteristicas-del-acetileno-300x230.jpg
Gracias a estos tipos de fuerzas electromagneticas para crear enlaces covalentes entre atomos de carbono y otros compuestos, es que el Carbono se une a muchos Atomos.









Comentarios
Publicar un comentario